Kesetimbangan Kimia
A. KABUT COKELAT DI LOS ANGELS
Tahukah Anda? Los Angels pernah dilanda kabut berwarna cokelat selama beberapa hari. Pada gambar 1, diketahui bahwa kabut tersebut memiliki bau yang menyengat dan menimbulkan berbagai penyakit pernafasan. Setelah diteliti, kabut tersebut diakibatkan karena konsentrasi gas NO2 yang tinggi di atmosfer. Gas NO2 dapat diakibatkan oleh tingginya emisi kendaraan bermotor dari mesin pembakaran internal dan asap industri yang konsentrasinya tinggi.
 |
Gambar 1. Kabut Asap Di LA Sumber: NASA |
Berdasarkan hasil dari penelitian, gas NO2 empat kali lebih beracun dibandingkan gas NO. Kadar gas NO2 yang melebihi 100 ppm dapat menyebabkan gangguan pada sistem pernafasan sehingga memicu berbagai penyakit pernafasan seperti atsma dan yang lebih fatal menyebabkan kematian. Udara yang mengandung gas NO namun dalam batas normal relatif aman dan tidak berbahaya. Gas NO akan menjadi lebih berbahaya apabila gas teroksidasi oleh oksigen pada suhu tinggi menjadi sehingga menjadi gas NO2 yang ditandai dengan gas berwarna cokelat dan berbau tajam.
Batas aman konsentrasi gas NO2 telah diatur pada Peraturan Pemerintah Republik Indonesia No 41 tahun 1999 tentang baku mutu gas NO2 di udara yaitu sebesar 400 μg/Nm3. Beberapa penelitian menyebutkan bahwa semakin banyak kendaraan dan asap industri, maka akan meningkatkan suhu lingkungan dan suhu yang tinggi merupakan salah satu faktor yang dapat meningkatkan pembentukan gas NO2. Lalu hubungannya peristiwa ini dengan kesetimbangan kimia apa? Berdasarkan Asas Le Chatelier, peningkatan suhu akan menggeser arah kesetimbangan pada reaksi endotermik (pembentukan NO2) berdasarkan reaksi 2NO2(g) ⇄ N2O4(g) ΔH = -52 kJ.
Nah berdasarkan peristiwa diatas bahwa kesetimbangan kimia itu sangat erat kaitannya dengan kehidupan manusia. Jadi, kesetimbangan kimia itu apa? Sebelum kita membahasnya, mari kita menonton video berikut
B. KESETIMBANGAN KIMIA DINAMIS
Kesetimbangan kimia yang dinamis merupakan proses di mana konsentrasi reaktan dan produk tetap konstan. Seiring waktu dan tingkat reaksi di arah ke depan cocok dengan tingkatnya di arah sebaliknya. Sebagai contoh, Di US Sekitar 95% gas hidrogen yang dibutuhkan oleh industri dihasilkan dalam proses dua langkah yang dimulai dengan bereaksi metana, komponen utama gas alam, dengan uap suhu tinggi:
 |
| Gambar 2. Konsentrasi Berubah Dari Waktu Ke Waktu Sampai Kesetimbangan Tercapai Sumber: The Science In Context, 2013 |
Pada
gambar 2 adalah reaksi reformasi uap-metana. Hal ini sangat endotermik, yang
mana biasanya dijalankan pada suhu antara 700°C dan 1000°C. Untuk meningkatkan tingkat reaksi, paduan
nikel atau nikel yang mengandung digunakan sebagai katalis dan reaksi
dijalankan pada tekanan setinggi 25 atm.
Pada langkah kedua, karbon monoksida yang dihasilkan dalam reaksi reformasi uap-metana bereaksi dengan lebih banyak uap untuk menghasilkan reaksi bereaksi dengan lebih banyak uap untuk menghasilkan lebih banyak gas hidrogen:
Reaksi ini, yang disebut reaksi pergeseran air-gas, juga membutuhkan katalis dan suhu reaksi lebih besar dari 350° C untuk mencapai reaksi. Kesimpulannya kesetimbangan dinamis merupakan suatu keadaan dimana dua proses yang berlawanan berlangsung pada kecepatan yang sama dan tidak ada perubahan konsentrasi senyawa-senyawa total dengan berjalannya waktu.
Contoh praktikum skala laboratorium mengenai kesetimbangan dinamis seperti pada video dibawah ini
dan adapun contoh ril dari kesetimbangan dinamis adalah sebagai berikut:
1. Penguapan
Apabila cairan menguap dalam tempat yang
tertutup seperti yang ditunjukkan pada gambar 3, maka ada waktu dimana molekul kembali ke keadaan cair pada kesepatan
yang sama dengan ketika molekul menguap meninggalkan keadaan cair.
 |
Gambar 3. Uap air dalam tutup panci Sumber: eatlogi.com |
Jadi, kecepatan pengembunan uap sama dengan kecepatan penguapan cairan. Meskipun molekul secara terus menerus bergerak bolak balik diantara keadaan cair dan gas (proses dinamis), keadaan tercapai jika tekanan uap tidak berubah/tetap dengan berjalannya waktu. Tekanan uap cairan adalah sifat yang berkaitan dengan keadaan setimbang.
2. Pelarutan
Apabila zat terlarut dilarutkan dalam pelarut, akan dicapai titik dimana kecepatan pelarutan partikel zat terlarut yang ditambahkan sama dengan kecepatan zat terlarut mengendap. Meskipun zat terlarut secara terus menerus bergerak bolak balik diantara keadaan larutan dan zat terlarut yang tidak larut (endapan), konsentrasi zat terlarut tidak berubah (tetap) dengan berjalannya waktu. Kelarutan zat terlarut adalah sifat yang berkaitan dengan keadaan setimbang.
 |
Gambar 4. Proses pelarutan zat terlarut kedalam pelarut Sumber: fisikaxkimiaasik.files.wordpress.com |
3. Distribusi
Apabila larutan air I2 dikocok dengan karbon tetraklorida, CCl4, maka molekul I2 akan bergerak bolak balik diantara air dan CCl4. Molekul terlarut akan terdistribusi dengan sendirinya diantara dua cairan yang tidak bercampur.
 |
| Gambar 5. Pereaksian antara lar. I2 dengan CCL4 Sumber: nursekey.com |
Pada gambar 5, ketika molekul terlarut melewati kedua cairan pada kecepatan yang sama, konsentrasi I2 dalam CCl4 kira-kira 85 kali dalam air, dan kedua konsentrasi tidak berubah (tetap) dengan berjalannya waktu. Perbandingan konsentrasi zat terlarut dalam kedua pelarut yang tidak bercampur disebut koefisien distribusi. Koefisien distribusi dari zat terlarut diantara dua pelarut yang tidak bercampur adalah sifat yang berkaitan dengan keadaan setimbang.
C. KESETIMBANGAN HOMOGEN DAN HETEROGEN
Suatu
reaksi kesetimbangan dikatakan homogen jika pereaksi dan hasil reaksi
memiliki fasa yang sama, sedangkan reaksi dikatakan heterogen jika salah satu
zat atau lebih berbeda fasa.
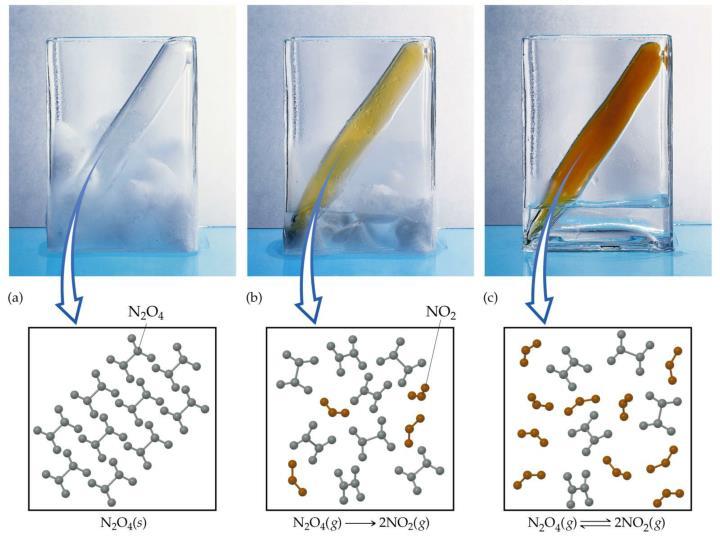 |
| Gambar 6. Pereaksian N2O4(g) → 2NO2(g) Sumber: alevelchemistry.co.uk |
CaCO3(s) → CaO(s) + CO2(g)
 |
| Gambar 7. Dekomposisi CaCO3 ke CaO dan CO2 Sumber: The Science In Context, 2013 |
Prinsip-prinsip kesetimbangan kimia juga berlaku untuk reaksi yang mengandung padatan dan cairan, terutama reaksi dalam larutan. Kesetimbangan di mana produk dan reaktan semuanya dalam fase yang sama disebut kesetimbangan homogen. Kesetimbangan di mana reaktan dan produk berada dalam fase yang berbeda adalah kesetimbangan heterogen.
Konsep konsentrasi konstan juga berlaku untuk cairan murni yang terlibat dalam reaksi kimia reversibel. Selama cairan itu ada, "konsentrasi" nya dianggap konstan selama reaksi dan tidak muncul dalam kesetimbangan ekspresi konstan. Demikian pula, sebagian besar ekspresi K untuk reaksi dalam larutan berair tidak termasuk istilah untuk H2O, bahkan ketika air adalah reaktan atau produk, karena konsentrasinya tidak berubah secara signifikan. Singkatnya, secara tertulis ekspresi konstan ekuilibrium untuk kesetimbangan heterogen, kita mengikuti aturan kami belajar sebelumnya, dengan aturan tambahan bahwa padatan dan cairan murni tidak muncul di ekspresi.
D. TETAPAN KESETIMBANGAN (KC DAN KP)
Kc adalah tetapan kesetimbangan konsentrasi yang nilainya tetap sama selama suhu tetap. Sedangkan Kp adalah tetapan kesetimbangan berdasarkan tekanan gas.
1. Rumus Tetapan Kesetimbangan Konsentrasi (Kc)Hukum Cato Guldberg dan Waage menyatakan bahwa:
"Dalam kesetimbangan pada suhu tetap, hasil kali konsentrasi zat-zat hasil reaksi dibagi dengan hasil kali konsentrasi pereaksi yang sisa dimana masing-masing konsentrasi itu dipangkatkan dengan koefisien reaksinya adalah tetap."Pernyataan tersebut dapat dinyatakan dalam bentuk matematis dalam persamaan kesetimbangan konsentrasi Kc seperti rumus dibawah ini:
Diberikan suatu reaksi kesetimbangan: pA + qB ⇄ rC + sD
Maka, tetapan kesetmbangan konsentrasi (Kc) adalah:
Dengan keterangan:
Kc = tetapan kesetimbangan konsentrasi
[A] = konsentrasi zat A
[B] = konsentrasi zat B
[C] = konsentrasi zat C
[C] = konsentrasi zat D
p, q, r, dan s = koefisien pada reaksi kesetimbangan
Zat-zat yang terdapat dalam kesetimbangan dapat berbentuk padat (s), larutan (aq), gas (g), atau cair (l). konsentrasi zat yang memengaruhi laju reaksi hanya dari zat-zat dengan fasa gas atau larutan. Sehingga konsenrasi zat yang berpengaruh dalam rumus tetapan kesetimbangan juga hanya zat-zat yang berupa gas atau larutan.padatan dan cairan murni tidak memengaruhi kesetimbangan. Hal ini dikarenakan padatan dan cairan murni tidak berubah meskipun terdapat perubahan volume atau suhu pada kesetimbangan konsentrasi.
Harga Kc pada suatu reaksi yang sama hanya dipengaruhi suhu. Dengan kata lain, selama suhu tetap maka nilai tetapan kesetimbangan (K) juga akan tetap. Perubahan harga K tergantung pada jenis reaksinya/ pada reaksi endoterm, harga/nilai K berbanding lurus dengan suhu, sedangkan pada reaksi eksoterm harga /nilai K berbanding terbalik dengan suhu. Percobaan skala laboratorium pada percobaan tetapan kesetimbangan konsentrasi atau Kc adalah seperti pada video berikut
2. Rumus Tetapan Kesetimbangan Tekanan Parsial Gas (Kp)
Persamaan rumus kesetimbangan Kp sama dengan hasil kali tekanan parsial gas produk dibagi dengan hasil kali tekanan parsial gas reaktan. Setiap konsentrasi zat pada persamaan kesetimbangan dipangkatkan koefisien reaksinya. Jika koefisien setiap zat sama dengan satu maka tidak perlu dituliskan bilangan pangkatnya.
Rumus
tetapan kesetimbangan tekanan gas (Kp) secara sistematis adalah:
Diberikan reaksi kesetimbangan: pA + qB ⇄ rC + sD
Maka, tetapan kesetmbangan konsentrasi (Kp) adalah:
Dengan
keterangan
Kp
= tetapan kesetimbangan tekanan gas
PA = tekanan parsial gas A = Mol A / Mol total x P total
PB
= tekanan parsial gas B = Mol B / Mol total x P total
PC
= tekanan parsial gas C = Mol C / Mol total x P total
PD
= tekanan parsial gas D = Mol D / Mol total x P total
3. Hubungan Kc dan Kp
Antara tetapan kesetimbangan berdasarkan konsentrasi dan tekanan gas memiliki suatu hubungan. Hubungan antara Kc dan Kp dapat ditentukan dalam sebuah persamaan. Melalui persamaan umum gas ideal pV = nRT dapat diperoleh hubungan antara Kc dan Kp.
Hubungan Kc dan Kp dapat dinyatakan seperti persamaan dibawah ini:
Kp = Kc.(RT)∆n
Dengan
keterangan
Kp
= tetapan kesetimbangan tekanan gas
Kc
= tetapan kesetimbangan konsentrasi
∆n
= selisih jumlah koefisien gas reaktan dan produk
R
= tetapan gas = 0,082 L.atm/mol.k
T
= suhu (K = ℃ + 273)
E. PRINSIP LE CHATELIER
 |
| Gambar 8. Labu ukur berisi campuran gas NO2 dan N2O4 Sumber: The Science In Context, 2013 |
Setelah
reaksi kimia terjadi pada kesetimbangan, komposisi sistem tetap tidak berubah
selama tidak ada kekuatan eksternal yang mengganggunya. Pada bagian ini kita
memeriksa apa yang terjadi ketika sistem pada kesetimbangan terganggu. Anggap misalnya,
labu di sebelah kiri pada Gambar 8 yang berisi kesetimbangan campuran dua gas:
NO2 dan dimer, N2O4, pada 25°C. NO2
adalah gas coklat; N2O4 tidak berwarna. Reaksi dimerisasi
yang sesuai dan kesetimbangannya konstanta adalah:
2NO2(g) ⇄ N2O4(g) KP = 6.9
Labu di sebelah kanan pada Gambar 8 awalnya mengandung campuran NO2 dan N2O4 di sebelah kiri, tetapi kemudian ditempatkan di bak es pada 0°C. Mengapa perubahan suhu menyebabkan perubahan warna pada labu di sebelah kanan? Faktor-faktor lain apa yang dapat mengganggu keseimbangan, dan bagaimana kita menjelaskan setiap perubahan dalam sistem?
 |
| Gambar 9. Henri Loius Le Chatelier Sumber: gracesguide.co.uk |
Salah
satu ilmuwan pertama yang mempelajari dan kemudian berhasil memprediksi bagaimana
kimia keseimbangan menanggapi gangguan tersebut adalah kimiawan Perancis Henri
Louis Le Châtelier (1850–1936). Dia mengartikulasikan prinsip Le Châtelier,
yang menyatakan bahwa, jika sistem pada kesetimbangan terganggu (atau mengalami
stress eksternal), posisi kesetimbangan bergeser ke arah maju atau mundur
sebagai respon untuk mengurangi stres tersebut. Kami sekarang mempertimbangkan
efek dari beberapa tekanan, termasuk perubahan konsentrasi, tekanan, volume,
dan suhu.
1. Perubahan Konsentrasi
Adanya perubahan konsentrasi baik itu penambahan maupun pengurangan konsentrasi akan merubah keadaan kesetimbangan suatu sistem. Adanya perubahan kesetimbangan bertujuan untuk memnimimalissasi adanya perubahan pada sistem. Praktikum sederhana dalam perubahan konsentrasi dapat dilakukan praktikum dari rumah dengan alat dan bahan yang mudah didapatkan seperti video berikut
Aturan-aturan dalam perubahan konsentrasi:
- Jika ada penambahan konsentrasi suatu zat maka kesetimbangan akan bergeser kearah yang menjauhi zat tersebut
- Jika ada pengurangan konsentrasi suatu zat maka kesetimbangan akan bergeser kea rah yang mendekati zat tersebut
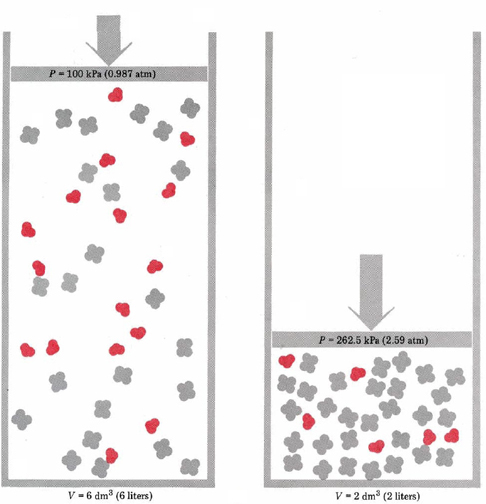
Adanya penambahan ataupun pengurangan tekanan dan volume pada system akan menggeser kesetimbangan, hal ini bertujuan agar perubahan yang terjadi pada sistem dapat diminimalisasi.
Gambar 10. Contoh perubahan tekanan dan volume
Sumber: chem.libretexts.org
Aturan-aturan dalam perubahan tekanan dan volume:
- Penambahan tekanan dengan cara memperkecil volume akan memperbesar konsentrasi semua komponen. Maka sistem akan bereaksi dengan mengurangi ikatan. Untuk mengurangi tekanan maka reaksi kesetimbangan akan bergeser ke arah yang jumlah koefisiennya lebih kecil
- Jika tekanan dikurangi dengan cara memperbesar volumenya, maka sistem akan bereaksi dengan menambah tekanan dengan cara menambah jumlah molekul. Reaksi akan bergeser kearah yang jumlah koefisiennya lebih besar
- Pada sistem kesetimbangan dimana jumlah koefisien reaksi sebelah kiri = jumlah koefisien sebelah kanan, maka perubahan tekanan atau volume tidak menggeser letak kesetimbangannya.
Adanya perubahan suhu pada sistem juga akan menggeser kesetimbangan. Pergeseran kesetimbangan bertujuan agar sistem Kembali pada suhu awalnya. Bila pada sistem kesetimbangan suhu dinaikkan, maka kesetimbangan reaksi akan bergeser ke arah yang membutuhkan kalor (kearah reaksi endoterm).
Gambar 11. Contoh perubahan suhu
Sumber: kimia100.com
LATIHAN SOAL
Jawablah soal dibawah ini dengan cermat dan teliti, berilah tanda (×) pada opsi jawaban yang dianggap benar!
1. Suatu sistem reaksi dalam keadaan setimbang bila…
a. Reaksinya berlangsung dua arah pada waktu bersamaan
b. Reaksi berlangsung dalam dua arah dalam laju reaksi yang sama
c. Jumlah mol zat yang ada pada keadaan setimbang selalu sama
d. Masing-masing zat yang bereaksi sudah habis
e. Jumlah zat yang terbentuk dalam reaksi sama dengan pereaksi
2. Suatu sistem kesetimbangan bersifat dinamis-mikroskopis, artinya..
a. Perubahan berlangsun terus menerus dan dapat diamati
b. Reaksi terus berlangsung ke kanan dan ke kiri dan dapat diamati
c. Reaksi terus berlangsung ke kanan dan kekiri tetapi tidak teramati
d. Perubahan berlangsung terus berhenti sehingga tidak dapat diukur
e. Perubahannya terhenti dan dapat terukur
3. Suatu reaksi dapat balik dikatakan mencapai keadaan setimbang jika...
a. Harga tetapan kesetimbangan Kc=1
b. Harga ketetapan kesetimbangan Kc=0
c. Kecepatan reaksi kekanan sama dengan kekiri
d. Jumlah mol zat sebelum dan sesudah reaksi sama
e. Massa zat sebelum dan sesudah reaksi sama
4. Berikut adalah factor-faktor yang mempengaruhi kesetimbangan suatu reaksi reversible, kecuali...
a. Suhu
b. Volume
c. Tekanan
d. Konsentrasi
e. Katalis
5. Jika terhadap suatu system kesetimbangan dilakukan suatu aksi, pada system akan terjadi suatu reaksi sehingga pengaruh aksi terhadap system menjadi sekecil mungkin. Asas ini dikemukakan oleh…
a. Van’t haff
b. De Broglie
c. Le Chatelier
d. Hess
e. Dalton
6. Pada keadaan kesetimbangan kimia, pernyataan berikut yang benar adalah...
a. Mol pereaksi yang berubah sama dengan mol zat yang terbentuk
b. Konsentrasi zat-zat dalam campuran reaksi tidak berubah
c. Laju reaksi maju lebih cepat daripada laju reaksi balik
d. Mol zat pereaksi sama dengan mol zat hasil reaksi
e. Reaksi telah berganti
7. Reaksi 2N2O5 (g) ⇄ 4O2 (g) + O2 (g) adalah reaksi eksotermik. Jika temperature dinaikkan, maka yang terjadi adalah…
a. NO2 dan O2 bertambah
b. NO2 dan O2 berkurang
c. NO2 dan N2O5 berkurang
d. NO2 dan N2O5 bertambah
e. N2O5 dan NO2 berkurang
8. Sistem
kesetimbangan H2 (g) + I2 (g) ⇄ 2HI(g) ![]() H = -52 kJ tidak akan
terganggu jika…
H = -52 kJ tidak akan
terganggu jika…
a. Temperature dinaikkan
b. Temperature diturunkan
c. Ditambah gas hydrogen
d. Digambah gas HI
e. Tekanan diperbesar
9. Pembuatan
gas NH3 di pabrik: N2 (g) + 3H2 (g) ⇄ 2NH3 (g)
![]() H = -x kJ. Hasil gas NH3 dapat diperbesar dengan cara…
H = -x kJ. Hasil gas NH3 dapat diperbesar dengan cara…
a. Memperbesar tekanan
b. Memperbesar volume
c. Memperbesar temperature
d. Menambah katalis
e. Mengurangi gas N2
10. Untuk reaksi kesetimbangan:
2NO2 (g) ⇄ 2NO (g) + O2 (g) ![]() H = - 58,02 kJ
H = - 58,02 kJ
Coklat tak berwarna
Jika temperature dinaikkan, maka arah
pergeseran kesetimbangan, harga K, dan warna reaksi adalah…
a. Kekiri, makin kecil, berwarna coklat
b. Kekiri, berwarna coklat, makin kecil
c. Makin kecil, kekiri, berwarna coklat,
d. Berwarna coklat, kekiri, makin kecil
e. Makin kecil, berwarna coklat, kekiri
Jawablah soal dibawah ini dengan cermat dan teliti, jawaban tulis dengan lengkap beserta rumusnya!
1. Campuran 0,08 mol NO; 0,06 mol H2 ;0,12 mol N2; dan 0,36 mol H2O ditempatkan dalam bejana 2L sehingga membentuk reaksi kesetimbangan: 2NO(g) + 2H2(g) ⇄ N2(g) + 2H2O(g). jika pada kesetimbangan [NO] = 0,02M, maka harga Kc untuk reaksi tersebut adalah?
2. Pada reaksi kesetimbangan 2X(s) ⇄ Y(s) + 2Z(s) apabila tekanan setelah setimbang 1,5 atm, maka harga Kp adalah?
3. Pada reaksi kesetimbangan: PCl5(g) ⇄ PCl3(g) + Cl2(g). Pada suhu 27C mempunyai nilai Kc = 0,04. Maka, nilai Kp pada kesetimbangan tersebut adalah?
4. Dalam ruang 1 liter sebanyak 0,6 mol gas PCl5 dipanaskan menurut reaksi:
PCl5(g) ⇄ PCl3(g) + Cl2(g)
Dalam kesetimbangan dihasilkan 0,2 mol gas Cl2 jika temperature pada ruangan 300K dan harga R = 0,082. Tentukan harga Kpnya!
5. Kedalam ruangan tertutup dimasukan 1 mol gas A dan 1 mol gas B. setelah bereaksi menurut persamaan 2A + 3B ⇄ A2B3 dan dicapai masih terdapat 0,25 mol gas B. Jika volume ruang 1 dm3, maka tetapan kesetimbangan reaksi tersebut adalah?
GLOSARIUM
|
Kesetimbangan
Kimia |
:
Keadaan
ketika laju reaksi maju sama dengan laju reaksi balik. |
|
Kesetimbangan
Dinamis |
:
Keadaan
ketika reaksi berlangsung terus menerus dan kecepatan membentuk zat produk
sama dengan kecepatan menguraikan zat pereaksi. |
|
Keesetimbangan
Homogen |
:
Kesetimbangan
kimia dimana seluruh zat yang terlibat dalam persamaan reaksi mempunyai wujud
yang sama atau memiliki fasa yang sama. |
|
Kesetimbangan
Heterogen |
:
Kesetimbangan
kimia dimana seluruh zat-zat yang terlibat dalam persamaan reaksi mempunyai
wujud berbeda-beda atau memiliki fasa yang berbeda. |
|
Tetapan
Kesetimbangan |
:
Perbandingan
hasil kali molaritas produk dengan hasil kali molaritas reaktan yang
masing-masing dipangkatkan dengan koefisiennya. |
|
Kc |
:
Tetapan
kesetimbangan konsentrasi yang nilainya tetap selama suhu tetap. |
|
Kp |
:
Tetapan
kesetimbangan berdasarkan tekanan gas. |
|
Azas
Le Chatelier |
:
Asas yang digunakan untuk memprediksi pengaruh perubahan kondisi pada
kesetimbangan kimia. Faktor yang mempengaruhi kesetimbangan kimia: 1. Pengaruh
konsentrasi 2. Pengaruh
suhu 3. Pengaruh
tekanan dan volume 4. Pengaruh
katalis |
DAFTAR PUSTAKA
Brown, L. M. (2009). Chemistry The
Central Science 11th eds. Pearson Educational , 626 - 665.
Dogra, S. (1990). Kimia Fisika dan Soal-soal. Jakarta: Universitas Indonesia.
Gilbert, T. R., Kirss. R. V., Foster, N., & Davies, G. (2013). The Science In Context. WW Norton & Company.





Comments
Post a Comment